
 更新时间:2025-12-31
更新时间:2025-12-31 点击次数:304
点击次数:304
在糖尿病伤口治疗领域,传统敷料如纱布、绷带等功能单一,难以应对糖尿病伤口复杂的病理微环境。高血糖状态易导致伤口持续感染、炎症反应失衡、氧化应激加剧及血管生成受阻,这些因素相互交织,形成恶性循环,严重阻碍愈合进程。今天分享的文献提出并构建了一种基于表没食子儿茶素没食子酸酯(EGCG)、羧甲基壳聚糖(CMCS)和2-甲酰基苯硼酸(2-FPBA)的新型双动态共价交联水凝胶敷料,该水凝胶不仅具备良好的力学性能(粘附、可注射、可塑形与自愈合)、pH响应性药物释放和近红外光热特性,还具有显著的抗菌、抗氧化、抗炎和促血管生成活性;更为突出的是,该水凝胶能够通过喷涂天然有机酸(如柠檬酸、水杨酸和维生素C)实现按需剥离,避免更换敷料时对伤口的二次损伤,从而在糖尿病小鼠全层皮肤缺损模型中有效促进伤口愈合,相关研究成果在Chemical Engineering Journal (IF=13.2, Q1) 上以题名为On-demand detachable adhesive hydrogel based on dual dynamic covalent cross-linked with NIR/pH dual-responsive properties for diabetic wound healing发表,下面小编带大家看一下该研究的具体内容。

该研究通过一锅法快速构建了基于双动态共价交联的粘附性水凝胶,其核心是利用羧甲基壳聚糖(CMCS)的氨基与2-甲酰基苯硼酸(2-FPBA)的醛基形成希夫碱键,同时通过2-FPBA的硼酸基团与表没食子儿茶素没食子酸酯(EGCG)的酚羟基形成硼酸酯键,从而形成双重动态交联网络;随着EGCG含量的增加,水凝胶由淡黄色转变为深棕色,结构更为致密,且多种表征手段(SEM、UV-vis、FT-IR、XPS、¹H NMR)均证实了这两种动态键的成功构建与均匀分布,为后续赋予水凝胶多重响应性与功能奠定了基础。

作者团队对水凝胶的力学与流变性能进行了系统表征。粘附性测试表明,水凝胶能牢固粘附于多种材料及湿态生物组织表面,其对猪皮的粘附强度随EGCG含量增加而提升,可达17.51 kPa,显著高于商用纤维蛋白胶。压缩测试显示,随着EGCG比例增加,水凝胶能承受更高的应力(>90 kPa),这得益于动态共价键网络的可逆重构能力。流变学分析进一步证实,水凝胶表现出典型的类固体弹性行为(G' > G''),且其模量和结构强度随EGCG含量增加而增强;在交替应变循环测试中,水凝胶展现出优异的自愈合性能,其网络结构能在破坏后迅速恢复,这为材料在伤口处的长期稳定贴合和通过注射进行微创填充应用提供了关键保障。

后续作者重点验证了水凝胶的光热性能及其对抗菌活性的增强作用。结果显示,由于EGCG带来的深棕色泽赋予了材料显著的光热转换能力,水凝胶在808 nm近红外光照射下能快速升温,且升温幅度随EGCG含量及激光功率密度的增加而提高,并表现出良好的循环稳定性;同时,光热效应能加速EGCG从水凝胶中的释放。在抗菌方面,水凝胶本身对革兰氏阳性菌(如金黄色葡萄球菌、MRSA)和革兰氏阴性菌(如大肠杆菌、沙门氏菌)均表现出明显的抑制效果,且抗菌活性随EGCG含量增加而增强;更重要的是,结合近红外光照射后,其抗菌效果得到极大提升,几乎能杀灭测试菌种,扫描电镜观察也证实经“水凝胶+NIR"处理的细菌形态发生严重损毁。这表明该水凝胶兼具内在的抗菌能力与外部光热协同杀菌功能,能有效应对糖尿病伤口易感染的难题。
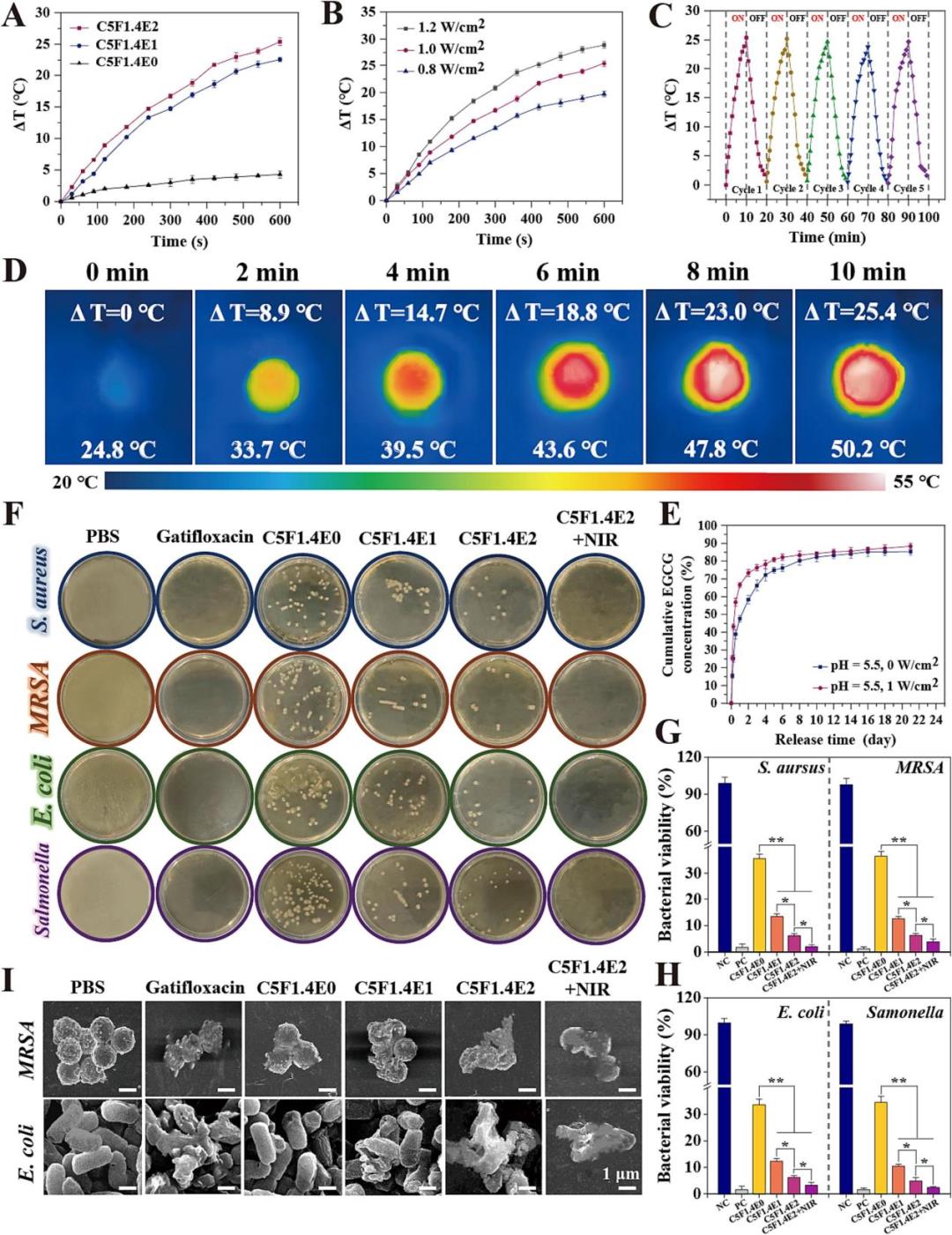
接下来作者系统评估了水凝胶的体外抗氧化能力。通过DPPH和PTIO自由基清除实验发现,水凝胶的自由基清除率随EGCG含量增加而显著提升,其中CSF1.4E2水凝胶对两者的清除率分别高达95.1%和90.2%,这主要归因于EGCG分子中密集的酚羟基所赋予的强大还原能力。在细胞层面,使用DCFH-DA探针检测NIH-3T3细胞内活性氧(ROS)水平的结果表明,与水凝胶提取物共培养后,由Rosup或H₂O₂诱导产生的过量ROS被有效清除,荧光强度随EGCG含量增加而快速减弱;流式细胞术定量分析进一步证实,CSF1.4E2处理组细胞的ROS阳性率较低(仅4.97%)。这些结果共同证明了该水凝胶能有效缓解氧化应激,为改善糖尿病伤口中因高糖和感染导致的ROS过度累积的病理微环境提供了关键功能。
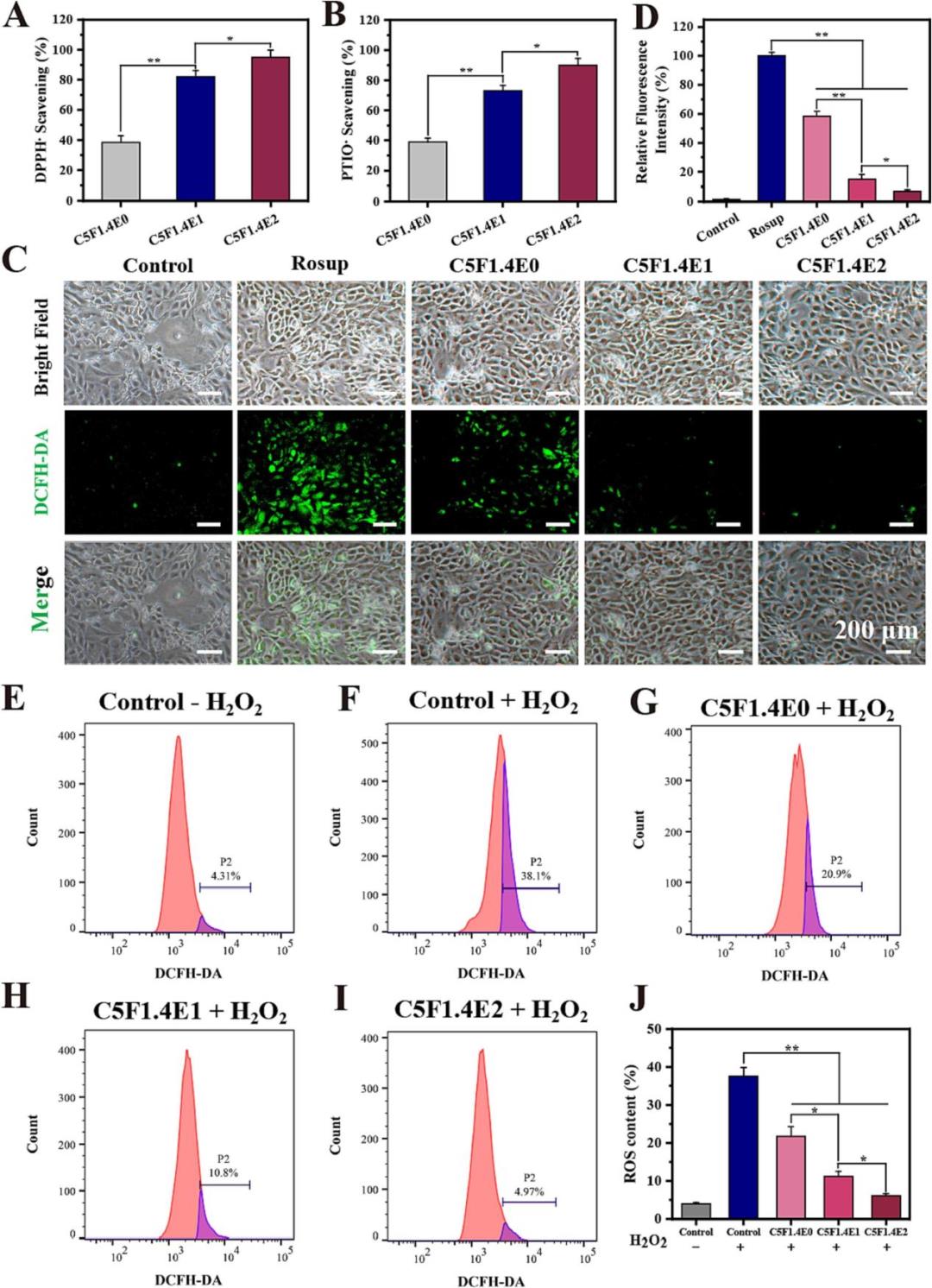
而后作者继续深入评估了水凝胶的体外抗炎活性。在脂多糖(LPS)和干扰素-γ(IFN-γ)刺激的RAW 264.7巨噬细胞炎症模型中,水凝胶能有效抑制关键促炎因子TNF-α和IL-1β的表达,且抑制效果随EGCG含量增加而增强。更重要的是,通过流式细胞术与免疫荧光染色分析巨噬细胞表型发现,水凝胶处理能显著降低促炎的M1型巨噬细胞(CD86+标志)比例,同时提高抗炎、促修复的M2型巨噬细胞(CD206+标志)比例,表明其能有效调控巨噬细胞从促炎表型向促愈合表型极化。这些结果共同证明,该水凝胶不仅能直接抑制炎症介质释放,还能通过调节免疫细胞功能来逆转糖尿病伤口中常见的持续性炎症状态,为创建有利于组织再生的微环境提供了关键机制。
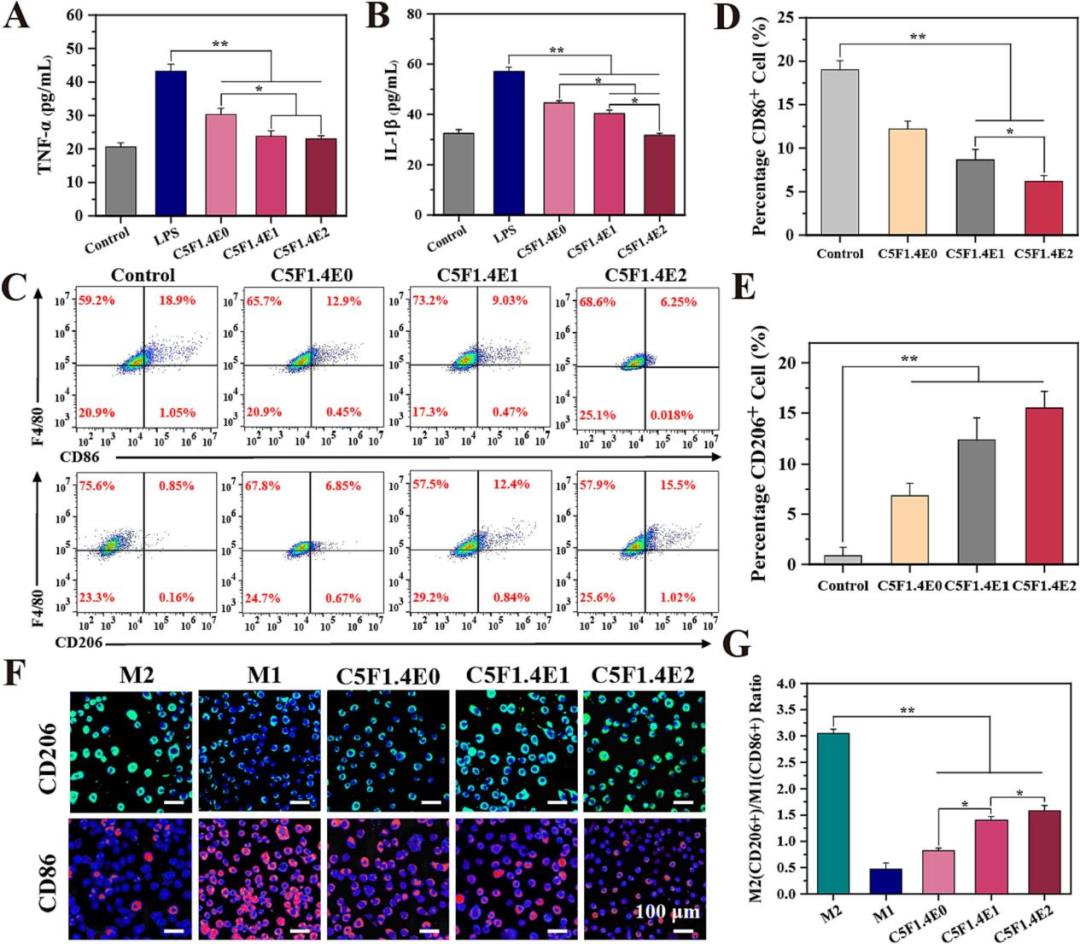
水凝胶的生物相容性及促血管生成
该研究系统评估了水凝胶的体外细胞相容性及其对细胞增殖、迁移和血管形成的促进作用。细胞活性与增殖实验表明,水凝胶提取物对NIH-3T3、RAW 264.7和HUVECs等多种细胞均显示出良好的生物相容性,并能显著促进细胞增殖,该效应随EGCG含量增加而增强,且近红外照射可进一步放大此效果。划痕与Transwell迁移实验证实,水凝胶能有效加速NIH-3T3和HUVECs的迁移过程,且迁移能力与EGCG含量呈正相关。尤为重要的是,体外血管形成实验清晰显示,CSF1.4E2水凝胶(特别是联合NIR组)能显著诱导人脐静脉内皮细胞形成更复杂、更长的管状网络结构。这些结果综合表明,该水凝胶不仅具备优异的生物安全性,更能通过直接刺激细胞增殖、迁移及促血管生成等关键环节,为加速糖尿病伤口愈合的细胞学基础提供了有力证据。
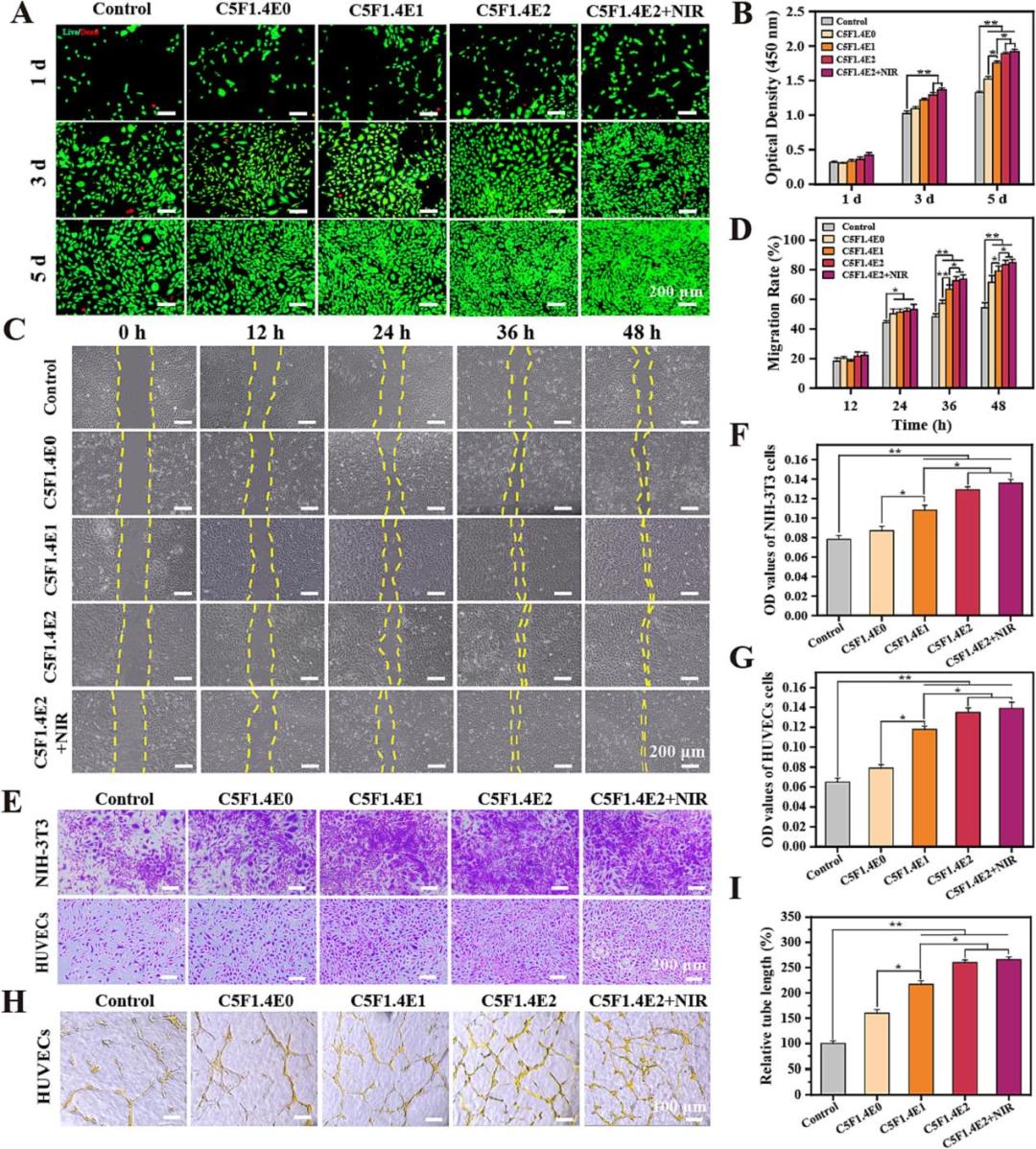
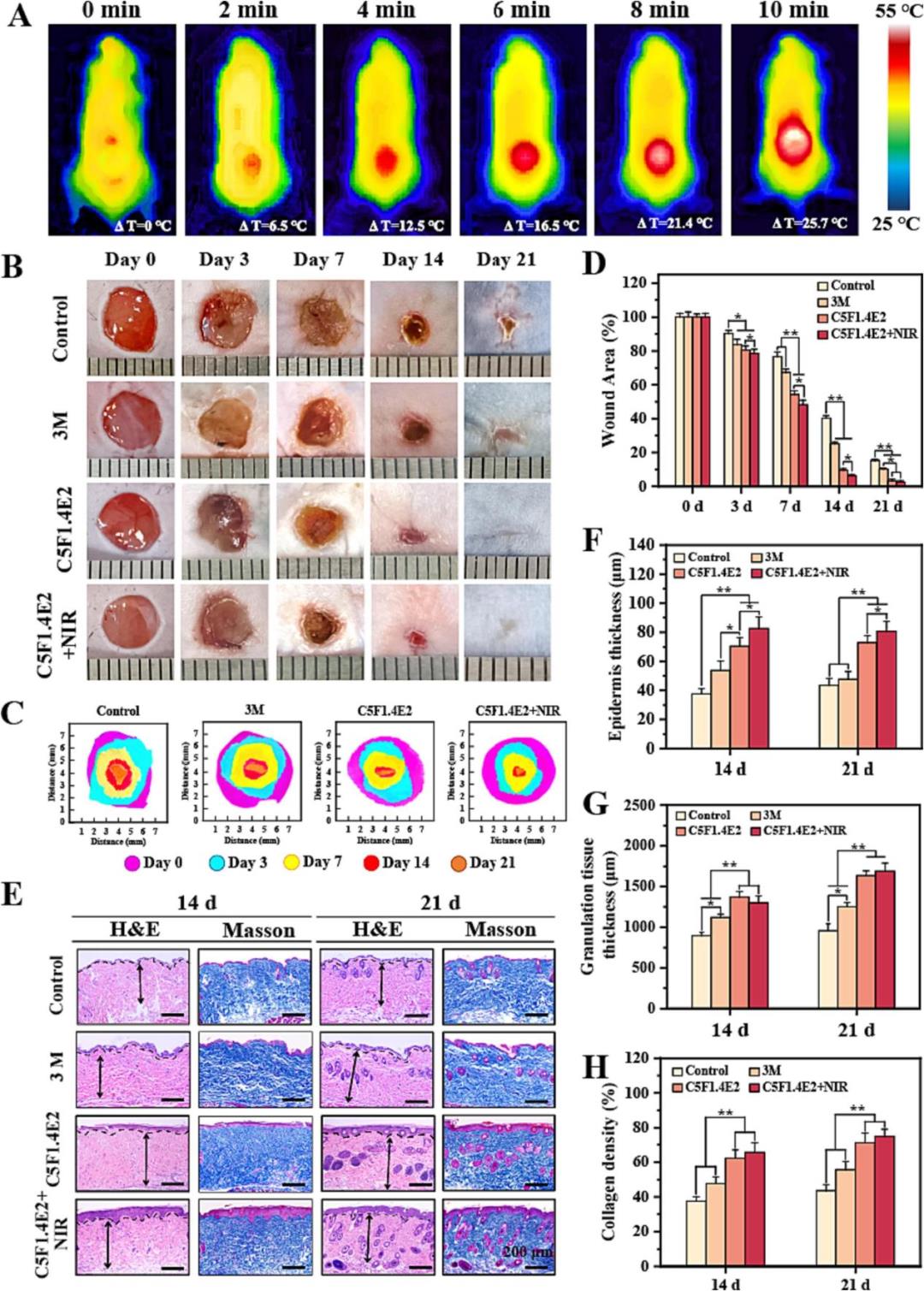
该研究通过建立糖尿病小鼠全层皮肤缺损模型,在体内验证了水凝胶对伤口愈合的显著促进作用。结果显示,负载水凝胶的伤口在近红外光照射下能实现精准、快速的局部升温。宏观观察与伤口面积定量分析表明,经CSF1.4E2水凝胶(尤其是联合NIR照射组)处理的伤口,其愈合速度明显快于对照组和商用敷料组,至第14天时伤口闭合率已超过90%。组织学分析(H&E和Masson染色)进一步揭示,水凝胶治疗能促进更完整的上皮再生、形成更厚的肉芽组织,并诱导更丰富、更致密的胶原沉积。这些结果从整体疗效到微观结构层面,共同证实了该水凝胶敷料能有效加速糖尿病伤口修复的关键进程,包括再上皮化、肉芽组织形成和细胞外基质重塑。
水凝胶促进血管生成和抑制基质过度降解
作者团队随后通过免疫荧光与蛋白质印迹等手段,深入揭示了水凝胶在体内促进糖尿病伤口血管生成、细胞增殖及调控细胞外基质代谢的关键作用。结果显示,经水凝胶(尤其是CSF1.4E2组)处理的伤口组织中,促血管生成因子(HIF-1α、VEGF)、血管标志物(CD31)及血管周细胞标志物(α-SMA)的表达均显著上调,且近红外(NIR)照射能进一步强化此效应,证明其能有效促进新生血管网络的形成。同时,细胞增殖标志物Ki-67表达显著增加,而凋亡标志物Caspase-3和过度降解细胞外基质的基质金属蛋白酶MMP2的表达则被明显抑制。这些结果共同表明,该水凝胶能协同创造一个利于组织再生的微环境:通过促进血管化保障营养与氧气供应,通过刺激细胞增殖并抑制凋亡来加速组织修复,并通过调控MMP2表达以维持细胞外基质的稳定沉积,从而多维度协同加速糖尿病伤口的愈合进程。

最后,作者团队通过RNA测序技术从分子层面深入阐释了水凝胶联合近红外光照射促进糖尿病伤口愈合的作用机制。主成分分析(PCA)清晰地显示了治疗组(CSF1.4E2+NIR)与对照组在基因表达谱上的显著差异。差异表达基因(DEGs)分析表明,治疗组共有798个基因发生显著变化,其中513个上调,285个下调;热图进一步显示,多个与皮肤修复相关的基因(如F2、Cdh16、Igfn1)被显著激活。通路富集分析(KEGG)揭示,治疗组中细胞粘附连接、细胞因子-细胞因子受体相互作用以及白细胞跨内皮迁移等与维持皮肤完整性、促进增殖血管化和抑制炎症密切相关的通路被显著上调。同时,基因本体(GO)分析表明,在治疗组中,涉及细胞与肌肉组织增殖、迁移、形态发生以及新基质形成等对伤口愈合至关重要的生物学过程得到显著富集。这些组学数据从系统水平证明,该水凝胶治疗策略能够通过协同调控多条关键信号通路与生物学过程,从促进修复、抑制炎症和重塑微环境等多维度共同驱动糖尿病伤口的加速愈合。
